लेखक:
Tamara Smith
निर्माण की तारीख:
22 जनवरी 2021
डेट अपडेट करें:
1 जुलाई 2024
विषय
- कदम बढ़ाने के लिए
- भाग 1 की 3: सांद्रता का मूल ज्ञान
- भाग 2 का 3: अनुमापन
- भाग 3 की 3: एक मछलीघर में लवणता का निर्धारण
- टिप्स
- चेतावनी
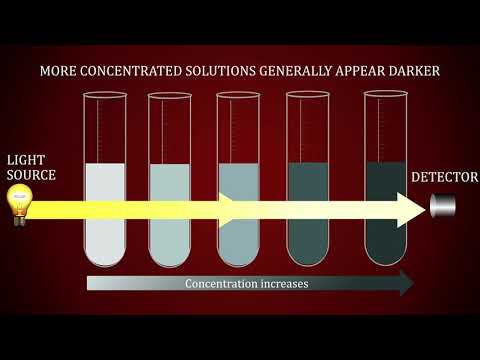
रसायन विज्ञान या रसायन विज्ञान में, एक समाधान दो चीजों का एक सजातीय मिश्रण - एक घुलने वाला पदार्थ और एक विलायक या विलायक जिसमें पदार्थ घुल जाता है। एकाग्रता विलायक में विलेय की मात्रा का एक माप है। एक समाधान की एकाग्रता को निर्धारित करने के लिए कई कारण हो सकते हैं, लेकिन इसमें शामिल रसायन विज्ञान एक ही है कि क्या आप एक पूल में क्लोरीन के स्तर का परीक्षण कर रहे हैं या रक्त के नमूने पर जीवन रक्षक विश्लेषण कर रहे हैं। यह मार्गदर्शिका आपको समाधान रसायन विज्ञान के कुछ बुनियादी हिस्सों को सिखाएगी, फिर आपको एक सामान्य, व्यावहारिक अनुप्रयोग - मछलीघर रखरखाव की प्रक्रिया के माध्यम से चलना होगा।
कदम बढ़ाने के लिए
भाग 1 की 3: सांद्रता का मूल ज्ञान
- सांद्रता की संकेतन विधि। किसी पदार्थ की सांद्रता विलायक की मात्रा से विभाजित उस विलेय की मात्रा है। हालांकि, क्योंकि किसी दिए गए पदार्थ की मात्रा को व्यक्त करने के विभिन्न तरीके हैं, इसलिए विभिन्न तरीकों से एक एकाग्रता का प्रतिनिधित्व करना भी संभव है। यहां आपको सबसे सामान्य वर्तनी मिलेगी:
- ग्राम प्रति लीटर (जी / एल) ग्राम में एक विलेय का द्रव्यमान एक घोल के दिए गए आयतन में घुल जाता है (जो कि विलायक की मात्रा के समान आवश्यक नहीं है।) आमतौर पर तरल सॉल्वैंट्स में ठोस के समाधान के लिए उपयोग किया जाता है।
- मोलरिटी (एम।) समाधान की मात्रा से विभाजित एक विलेय के मोल्स की संख्या।
- प्रति मिलियन पार्ट्स (पीपीएम) एक घोल के प्रति दस लाख कणों में एक विलेय के कणों (आमतौर पर ग्राम) की संख्या का अनुपात, 10. बहुत गुणा पानी के घोल (आमतौर पर 1 लीटर पानी = 1000 ग्राम) के लिए उपयोग किया जाता है।
- यौगिक पदार्थ का प्रतिशत। एक समाधान के प्रति 100 कणों के एक विलेय के कणों (ग्राम में फिर से) का अनुपात, प्रतिशत के रूप में व्यक्त किया जाता है।
- जानिए एकाग्रता को खोजने के लिए आपको किस डेटा की आवश्यकता है। मोलरिटी (नीचे देखें) को छोड़कर, एकाग्रता को लिखने के सामान्य तरीकों को ऊपर बताए अनुसार आपको विलेय के द्रव्यमान और परिणामस्वरूप समाधान के द्रव्यमान या मात्रा को जानना होगा। कई रासायनिक समस्याएं जिनके समाधान की एकाग्रता खोजने की आवश्यकता होती है, आपको यह जानकारी नहीं देती है। यदि हां, तो आपको इस जानकारी का पता लगाने के लिए क्या करना है, इसके साथ काम करना होगा।
- उदाहरण: मान लें कि हमें 2 लीटर पानी में 1/2 चम्मच नमक को घोलकर बनाया गया घोल (प्रति लीटर) में मिल रहा है। हम यह भी जानते हैं कि 1 चम्मच नमक लगभग 6 ग्राम है। इस मामले में, रूपांतरण आसान है - गुणा: 1/2 चम्मच x (6 ग्राम / 1 चम्मच) = 3 ग्राम नमक। 3 ग्राम नमक 2 लीटर या पानी से विभाजित = 1.5 ग्राम / एल
- मोलरिटी की गणना करना सीखें। मोलरिटी आपको अपने विलेय के मोल्स की संख्या जानने की आवश्यकता है, लेकिन यह आसानी से घटाया जा सकता है यदि आप विलेय के द्रव्यमान और रासायनिक सूत्र को जानते हैं। प्रत्येक रासायनिक तत्व में एक ज्ञात "मोलर द्रव्यमान" (MM) है - उस तत्व के एक तिल के लिए एक विशिष्ट द्रव्यमान। ये मोलर द्रव्यमान आवधिक तालिका में पाए जाते हैं (आमतौर पर रासायनिक प्रतीक और तत्व नाम के तहत।) केवल दाढ़ द्रव्यमान प्राप्त करने के लिए विलेय के घटकों के दाढ़ द्रव्यमान को जोड़ते हैं। फिर मोल्स में अपने विलेय की मात्रा का पता लगाने के लिए (अपने विलेय के 1 / MM) द्वारा विलेय के ज्ञात द्रव्यमान को गुणा करें।
- उदाहरण: मान लीजिए कि हम उपरोक्त नमकीन घोल की मात्रा का पता लगाना चाहते हैं। बस पुनरावृत्ति करने के लिए, हमारे पास 2 लीटर पानी में 3 ग्राम नमक (NaCl) है। आवर्त सारणी को देखकर यह पता लगाना शुरू करें कि Na और Cl के दाढ़ द्रव्यमान क्या हैं। Na = लगभग 23 g / mol और Cl = लगभग 35.5 g / mol। इस प्रकार, NaCl का एमएम = 23 + 35.5 = 58.5 ग्राम / मोल। 3 ग्राम NaCl x (1 मोल NaCl / 58.5 ग्राम NaCl) = 0.051 मोल NaCl। 0.051 मोल NaCl / 2 लीटर पानी = .026 एम NaCl
- सांद्रता की गणना पर मानक अभ्यास का अभ्यास करें। उपरोक्त ज्ञान आपको सरल स्थितियों में सांद्रता की गणना करने की आवश्यकता है। यदि आप समाधान के द्रव्यमान या मात्रा और सिद्धांत में जोड़े गए विलेय की मात्रा को जानते हैं, या आप इसे कथन में दी गई जानकारी से निकाल सकते हैं, तो आपको आसानी से समाधान की एकाग्रता को मापने में सक्षम होना चाहिए। अपने कौशल को बेहतर बनाने के लिए अभ्यास की समस्याएं बनाएं। नीचे दिए गए उदाहरण अभ्यास देखें:
- एक 400 मिलीलीटर समाधान में NaCL की दाढ़ क्या है, पानी में NaCl की 1.5 ग्राम जोड़कर प्राप्त की जाती है?
- पीपीएम में 0.001 ग्राम लेड (Pb) को 150 L पानी में मिला कर बनाए गए घोल में एकाग्रता क्या है? (पानी का 1 एल = 1000 ग्राम) इस मामले में, समाधान की मात्रा पदार्थ को जोड़कर एक ऋणात्मक राशि से बढ़ जाएगी, इसलिए आप समाधान की मात्रा के रूप में विलायक की मात्रा का उपयोग कर सकते हैं।
- पानी में 1/2 लीटर KCl जोड़कर बनाया गया एक 0.1 L समाधान प्रति लीटर ग्राम में एकाग्रता का पता लगाएं। इस समस्या के लिए, आपको विलेय में KCl के ग्राम की संख्या की गणना करने के लिए KCL के दाढ़ द्रव्यमान का उपयोग करते हुए, आगे से पीछे तक काम करना होगा।
भाग 2 का 3: अनुमापन
- जब एक अनुमापन लागू करने के लिए समझे। अनुमापन एक तकनीक है जिसका उपयोग रसायनज्ञ एक घोल में मौजूद विलेय की मात्रा की गणना के लिए करते हैं। एक अनुमापन प्रदर्शन करने के लिए, आप विलेय और एक और अभिकर्मक (आमतौर पर भी भंग) के बीच एक रासायनिक प्रतिक्रिया बनाते हैं। चूँकि आप अपने दूसरे अभिकर्मक की सही मात्रा जानते हैं और आप अभिकर्मक और विलेय के बीच प्रतिक्रिया के रासायनिक समीकरण को जानते हैं, आप अपने विलेय की मात्रा की गणना यह माप कर कर सकते हैं कि आपको अभिकर्मक के साथ अभिक्रिया की कितनी आवश्यकता है। पूर्ण।
- तो, एक समाधान की एकाग्रता की गणना में अनुमापन बहुत उपयोगी हो सकते हैं यदि आप नहीं जानते कि शुरू में कितना विलेय जोड़ा गया था।
- यदि आप जानते हैं कि समाधान में एक विलेय का कितना हिस्सा है, तो अनुमापन की आवश्यकता नहीं है - बस अपने समाधान की मात्रा को मापें और एकाग्रता की गणना करें, जैसा कि भाग 1 में वर्णित है।
- अपने अनुमापन उपकरण सेट करें। सटीक अनुमापन करने के लिए आपको स्वच्छ, सटीक और पेशेवर उपकरण की आवश्यकता होती है। एक मूत्रवर्धक धारक से जुड़ी एक कैलिब्रेटेड मूत्रवर्धक के तहत एक Erlenmeyer फ्लास्क या बीकर का उपयोग करें। मूत्रल का नोजल दीवारों को छुए बिना फ्लास्क या बीकर के गले में होना चाहिए।
- सुनिश्चित करें कि सभी उपकरण पहले साफ हो गए हैं, विआयनीकृत पानी से धोया गया है, और सूखा है।
- कुप्पी और मूत्रवर्धक भरें। अज्ञात समाधान की थोड़ी मात्रा को सटीक रूप से मापें। जब भंग हो जाता है, तो पदार्थ समान रूप से विलायक के माध्यम से फैलता है, इसलिए समाधान के इस छोटे नमूने की एकाग्रता मूल समाधान के समान होगी। एक ज्ञात एकाग्रता के समाधान के साथ अपने मूत्रवर्धक को भरें जो आपके समाधान के साथ प्रतिक्रिया करेगा। मूत्रवर्धक में घोल के सटीक आयतन पर ध्यान दें - प्रतिक्रिया में प्रयुक्त कुल विलयन ज्ञात करने के लिए अंतिम आयतन को घटाएँ।
- ध्यान दें: यदि फ्लास्क में सॉल्यूशन और विलेय में घोल के बीच की प्रतिक्रिया प्रतिक्रिया का कोई संकेत नहीं दिखाती है, तो आप करेंगे सूचक फ्लास्क में। इनका उपयोग रसायन विज्ञान में एक दृश्य संकेत प्रदान करने के लिए किया जाता है जब कोई समाधान समतुल्यता या अंतिम बिंदु तक पहुंचता है। एसिड-बेस और रेडॉक्स प्रतिक्रियाओं की जांच करने वाले अनुमापन के लिए संकेतक आमतौर पर उपयोग किए जाते हैं, लेकिन कई अन्य संकेतक भी हैं। अपनी प्रतिक्रिया के लिए एक उपयुक्त संकेतक खोजने के लिए एक रसायन विज्ञान पाठ्यपुस्तक से परामर्श करें या इंटरनेट पर देखें।
- अनुमापन शुरू करें। धीरे-धीरे फ्लास्क में बोरेट ("टाइट्रेंट") से एक समाधान जोड़ें। जब प्रतिक्रिया चल रही हो तब घोल को मिलाने के लिए एक चुंबकीय हलचल स्टिक या ग्लास हलचल स्टिक का उपयोग करें। यदि आपका समाधान स्पष्ट रूप से प्रतिक्रिया कर रहा है, तो आपको कुछ संकेतों को देखना चाहिए कि एक प्रतिक्रिया हो रही है - रंग, बुलबुले, अवशेष, आदि में बदलाव। यदि आप एक संकेतक का उपयोग कर रहे हैं, तो आप हर बूंद को मूत्रवर्धक के माध्यम से सही फ्लास्क ए में आ सकते हैं। रंग परिवर्तन।
- यदि प्रतिक्रिया में पीएच मान या क्षमता में बदलाव होता है, तो आप रासायनिक प्रतिक्रिया की प्रगति का आकलन करने के लिए फ्लास्क में पीएच रीडर या एक पोटेंशियोमीटर जोड़ सकते हैं।
- अधिक सटीक अनुमापन के लिए, ऊपर के रूप में पीएच या क्षमता की निगरानी करें, और हर बार ध्यान दें कि टाइट्रेंट की थोड़ी मात्रा में जोड़ने के बाद प्रतिक्रिया कैसे होती है। समाधान की अम्लता या जोड़ा टाइट्रेंट की मात्रा बनाम क्षमता। आप प्रतिक्रिया की तुल्यता बिंदुओं पर वक्र के ढलान में तेज बदलाव देखेंगे।
- अपने अनुमापन को धीमा करें। जैसा कि आपकी रासायनिक प्रतिक्रिया अंत बिंदु के पास है, अनुमापन को एक ड्रॉपवाइज़ प्रगति के लिए धीमा कर दें। यदि आप एक संकेतक का उपयोग कर रहे हैं, तो आप देख सकते हैं कि रंग अधिक समय तक चलता है। अब धीरे-धीरे जितना संभव हो सके उतनी देर तक टटोलना जारी रखें, जब तक कि आप सटीक गिरावट का निर्धारण नहीं कर सकते हैं, जिससे आपकी प्रतिक्रिया अंतिम बिंदु तक पहुंच जाएगी। एक संकेतक के मामले में, आप आमतौर पर प्रतिक्रिया में जल्द से जल्द संभव रंग परिवर्तन को देखते हैं।
- अपनी मात्रा में अंतिम मात्रा रिकॉर्ड करें। मूत्रवर्धक में शुरुआती मात्रा से इसे घटाकर, आप उपयोग किए गए टाइट्रेंट की सटीक मात्रा पा सकते हैं।
- अपने समाधान में विलेय की मात्रा की गणना करें। अपने अनुमापांक के बीच प्रतिक्रिया के लिए रासायनिक समीकरण का उपयोग करें और अपने फ्लास्क में विलेय के मोल्स की संख्या का पता लगाएं। एक बार जब आप विलेय के मोल्स की संख्या पा लेते हैं, तो आप इसे समाधान की मात्रा को खोजने के लिए फ्लास्क में समाधान की मात्रा से विभाजित कर सकते हैं, या मोल्स की संख्या को ग्राम में बदल सकते हैं और समाधान की मात्रा से विभाजित कर सकते हैं। , जी / एल में एकाग्रता प्राप्त करने के लिए। इसके लिए स्टोइकोमेट्री का थोड़ा बुनियादी ज्ञान आवश्यक है।
- उदाहरण के लिए, मान लें कि हमने एचसीएल के घोल को पानी में समतुल्य बिंदु पर 25 मिलीलीटर 0.5 एम NaOH का उपयोग किया। HCl समाधान में अनुमापन के लिए 60 मिलीलीटर की मात्रा थी। हमारे समाधान में एचसीएल के कितने मोल हैं?
- आरंभ करने के लिए, आइए NaOH और HCl की प्रतिक्रिया के लिए रासायनिक समीकरण पर एक नज़र डालें: NaOH + एचसीएल> एच2ओ + नाक्
- इस मामले में, NaOH का 1 अणु उत्पादों के पानी और NaCl के साथ HCl के 1 अणु के साथ प्रतिक्रिया करता है। इसलिए क्योंकि आपने एचसीएल के सभी को बेअसर करने के लिए बस पर्याप्त NaOH जोड़ा, प्रतिक्रिया में भस्म NaOH की संख्या कुप्पी में एचसीएल के मोल्स की संख्या के बराबर होगी।
- तो आइए जानें कि मोल्स में NaOH की मात्रा क्या है। 25 मिली NaOH = 0.025 एल NaOH x (0.5 मोल NaOH / 1 एल) = 0.0125 तिल NaOH।
- चूँकि हमने रिएक्शन समीकरण से घटाया है कि NaOH के मोल्स की संख्या ने रिएक्शन में खपत की = घोल में HCl के मोल्स की संख्या, अब हम जानते हैं कि घोल में HCl के 0.0125 मोल्स हैं।
- अपने समाधान की एकाग्रता की गणना करें। अब जब कि आप अपने घोल में घोल की मात्रा जानते हैं, तो मोलरिटी के संदर्भ में एकाग्रता का पता लगाना आसान है। बस अपने घोल के घोल की मात्रा को अपने घोल के नमूने की मात्रा से विभाजित करें (नहीं बड़ी मात्रा की मात्रा जिसे आपने नमूना लिया था।) परिणाम आपके समाधान की मात्रा है!
- ऊपर दिए गए उदाहरण की व्यापकता को खोजने के लिए, फ्लास्क में वॉल्यूम द्वारा एचसीएल की संख्या को विभाजित करें। 0.0125 मोल HCl x (1 / 0.060 L) = 0.208 एम एचसीएल।
- Molarity को g / L, ppm या संरचना के प्रतिशत में परिवर्तित करने के लिए, अपने विलेय के मोल्स की संख्या को द्रव्यमान (अपने विलेय के मोलर द्रव्यमान का उपयोग करके) में कनवर्ट करें। ppm और कंपाउंड के प्रतिशत के लिए, आपको वॉल्यूम को भी कनवर्ट करना होगा। आपके द्रव्यमान के समाधान के लिए (रूपांतरण कारक जैसे घनत्व, या बस इसे तौलना करके), फिर परिणाम को क्रमशः 10 या 10 से गुणा करें।
भाग 3 की 3: एक मछलीघर में लवणता का निर्धारण
 अपने टैंक से पानी का नमूना लें। मात्रा को सही ढंग से रिकॉर्ड करें। यदि संभव हो, तो एसआई इकाइयों में मात्रा को मापें जैसे कि एमएल - ये एल में परिवर्तित करने के लिए आसान हैं।
अपने टैंक से पानी का नमूना लें। मात्रा को सही ढंग से रिकॉर्ड करें। यदि संभव हो, तो एसआई इकाइयों में मात्रा को मापें जैसे कि एमएल - ये एल में परिवर्तित करने के लिए आसान हैं। - इस उदाहरण में हम लवणता के लिए मछलीघर में पानी का परीक्षण करते हैं, पानी में नमक (NaCl) की एकाग्रता। मान लीजिए कि हम इस उद्देश्य के लिए पानी का नमूना लेते हैं 3 एमएल एक्वेरियम से और फिर दिए जाने वाले अंतिम उत्तर को सेट करें जी / एल।
 पानी का नमूना टिट्रेट करें। एक टाइटेंट चुनें जो विलेय में स्पष्ट रूप से दिखाई देने वाली प्रतिक्रिया पैदा करता है। इस मामले में हम 0.25 एम एग्नो के समाधान का उपयोग करते हैं3 (सिल्वर नाइट्रेट), एक यौगिक जो अघुलनशील क्लोरीन नमक पैदा करता है जब वह निम्न प्रतिक्रिया में NaCl के साथ प्रतिक्रिया करता है: अगनो3 + NaCl> नानो3 + AgCl। नमक (AgCl) बादल के सफेद अवशेषों के रूप में दिखाई देगा जो तैरता है और घोल से अलग किया जा सकता है।
पानी का नमूना टिट्रेट करें। एक टाइटेंट चुनें जो विलेय में स्पष्ट रूप से दिखाई देने वाली प्रतिक्रिया पैदा करता है। इस मामले में हम 0.25 एम एग्नो के समाधान का उपयोग करते हैं3 (सिल्वर नाइट्रेट), एक यौगिक जो अघुलनशील क्लोरीन नमक पैदा करता है जब वह निम्न प्रतिक्रिया में NaCl के साथ प्रतिक्रिया करता है: अगनो3 + NaCl> नानो3 + AgCl। नमक (AgCl) बादल के सफेद अवशेषों के रूप में दिखाई देगा जो तैरता है और घोल से अलग किया जा सकता है। - जब तक घोल न बन जाए, तब तक एक मूत्रवर्धक या छोटे इंजेक्शन सुई से सिल्वर नाइट्रेट को एक्वेरियम के नमूने में डालें। इस तरह के एक छोटे नमूने के साथ यह महत्वपूर्ण है बिल्कुल सही निर्धारित करें कि आपने कितना रजत नाइट्रेट जोड़ा है - प्रत्येक बूंद का सावधानीपूर्वक अध्ययन करें।
 प्रतिक्रिया समाप्त होने तक जारी रखें। जब सिल्वर नाइट्रेट घोल को छोड़ना बंद कर देता है, तो आप जोड़े गए मिलीलीटर की संख्या को नोट कर सकते हैं। AgNO3 शीर्षक बहुत धीमी गति से और विशेष रूप से अंत बिंदु दृष्टिकोण के रूप में समाधान का बारीकी से निरीक्षण करें।
प्रतिक्रिया समाप्त होने तक जारी रखें। जब सिल्वर नाइट्रेट घोल को छोड़ना बंद कर देता है, तो आप जोड़े गए मिलीलीटर की संख्या को नोट कर सकते हैं। AgNO3 शीर्षक बहुत धीमी गति से और विशेष रूप से अंत बिंदु दृष्टिकोण के रूप में समाधान का बारीकी से निरीक्षण करें। - मान लें कि 0.25 M AgNO के 3mL हैं3 प्रतिक्रिया समाप्त होने के लिए आवश्यक थी और पानी आगे नहीं बढ़ा।
- टाइट्रेंट के मोल्स की संख्या निर्धारित करें। यह चरण आसान है - दाढ़ द्वारा जोड़े गए टाइट्रेंट की मात्रा को गुणा करें। यह आपको इस्तेमाल किए गए टाइट्रेंट के मोल्स की संख्या देगा।
- 3 एमएल x 0.25 एम = 0.003 एल एक्स (.25 मोल्स एग्नो3/ 1 एल) = 0.000075 तिल अगनो3.
- अपने विलेय के मोल्स की संख्या निर्धारित करें। AgNO के मोल्स की संख्या को परिवर्तित करने के लिए प्रतिक्रिया समीकरण का उपयोग करें3 NaCl के मोल्स को। प्रतिक्रिया समीकरण है: अगनो3 + NaCl> नानो3 + AgCl। क्योंकि 1 तिल अगनो3 NaCl के 1 मोल के साथ प्रतिक्रिया करता है, अब हम जानते हैं कि हमारे समाधान में NaCl के मोल्स की संख्या = मोल्को की संख्या3 यह जोड़ा गया है: 0.000075 मोल।
- इस मामले में: एगो के 1 मोल3 NaCl के 1 मोल के साथ प्रतिक्रिया करता है। लेकिन अगर टाइटलर का 1 मोल हमारे विलेय के 2 मोल्स के साथ प्रतिक्रिया करता है, तो हम अपने विलेय के मोल्स की संख्या प्राप्त करने के लिए अपने टाइट्रेंट के मोल्स की संख्या को 2 से गुणा करेंगे।
- इसके विपरीत, यदि हमारे टाइट्रेंट के 2 मोल हमारे विलेय के 1 मोल के साथ प्रतिक्रिया करते हैं, तो हम टाइट्रेंट के मोल्स की संख्या को दो से विभाजित करते हैं।
- ये नियम आनुपातिक रूप से 3 मोल टाइटरेंट और 1 मोल के सॉल्यूशन, 4 मोल टाइट्रेंट और सॉल्यूट के 1 मोल इत्यादि के साथ-साथ 1 मोल टाइटनैंट और 3 मोल सॉल्यूट, 1 मोल टाइटरेंट और 4 मोल सॉल्यूट के अनुरूप होते हैं। आदि।
- अपने solute मोल्स की संख्या को ग्राम में बदलें। ऐसा करने के लिए आपको विलेय के दाढ़ द्रव्यमान की गणना करने की आवश्यकता होगी और इसे अपने विलेय के मोल्स की संख्या से गुणा करना होगा। NaCl के दाढ़ द्रव्यमान को खोजने के लिए, नमक (Na) और क्लोराइड (Cl) के परमाणु भार को खोजने और जोड़ने के लिए आवर्त सारणी का उपयोग करें।
- एमएम ना = 22,990। MM Cl = 35,453।
- 22,990 + 35,453 = 58.443 ग्राम / मोल
- 0.000075 तिल NaCl x 58.442 g / तिल = 0.00438 मोल NaCl।
- ध्यान दें: यदि किसी परमाणु में एक से अधिक प्रकार के अणु हैं, तो आपको उस परमाणु के दाढ़ द्रव्यमान को कई बार जोड़ना होगा। उदाहरण के लिए, यदि आप AgNO के दाढ़ द्रव्यमान हैं3, आप तीन बार ऑक्सीजन का द्रव्यमान जोड़ेंगे क्योंकि अणु में तीन ऑक्सीजन परमाणु होते हैं।
- अंतिम एकाग्रता की गणना करें। हमारे पास ग्राम में हमारे विलेय का द्रव्यमान है और हम परीक्षण समाधान की मात्रा जानते हैं। अब हमें बस इतना करना है: 0.00438 g NaCl / 0.003 L = 1.46 ग्राम NaCl / L
- समुद्र के पानी की लवणता लगभग 35 ग्राम NaCl / L है। हमारे मछलीघर समुद्री मछली के लिए पर्याप्त नमकीन नहीं है।
टिप्स
- यद्यपि विलेय और विलायक अलग-अलग अवस्थाओं (ठोस, तरल या गैस) में मौजूद हो सकते हैं, अलग होने पर, घुलने पर बनने वाला घोल, पदार्थ के घुलने की अवस्था के समान अवस्था में होगा।
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O
- केवल स्पष्ट प्लास्टिक या कांच का उपयोग करें।
- यहाँ एक उदाहरण वीडियो है: [१]
चेतावनी
- एक बंद, अंधेरे बोतल में AgNO3 समाधान स्टोर करें। यह प्रकाश के प्रति संवेदनशील है।
- मजबूत एसिड या अड्डों के साथ काम करते समय सावधान रहें। सुनिश्चित करें कि कमरे में पर्याप्त ताजी हवा है।
- सुरक्षा चश्मा और दस्ताने पहनें।
- यदि आप रजत वापस पाना चाहते हैं, तो निम्नलिखित पर ध्यान दें: Cu (s) + 2 AgNO3 (aq) → Cu (NO3) 2 + 2 Ag (s) याद रखें कि (ओं) का अर्थ है ठोस।



