विषय
किसी भी रासायनिक प्रतिक्रिया में, गर्मी को या तो अवशोषित किया जा सकता है या परिवेश में जारी किया जा सकता है। रासायनिक प्रतिक्रिया और उसके आस-पास के तापमान का आदान-प्रदान किया जाता है, जिसे प्रतिक्रिया का मुख्य भाग कहा जाता है, जिसे H द्वारा दर्शाया जाता है। हालांकि, H को सीधे मापा नहीं जा सकता है, लेकिन इसके बजाय तापमान में परिवर्तन को मापता है। समय के साथ प्रतिक्रिया की डिग्री का उपयोग समय के साथ आंत्रशोथ की भिन्नता की गणना करने के लिए किया जाता है (द्वारा चिह्नित) ΔH)। एक प्रतिक्रिया के एच को जानने के बाद, हम यह निर्धारित कर सकते हैं कि यह एंडोथर्मिक है (प्रतिक्रिया की गर्मी पर्यावरण से ली गई है) या एक्सोथर्मिक (प्रतिक्रिया की गर्मी पर्यावरण को विकिरण करती है)। जहां m अभिकारक का द्रव्यमान है, s उत्पाद की विशिष्ट ऊष्मा है, प्रतिक्रिया के दौरान duringT तापमान परिवर्तन होता है, हमारे पास है ∆H = म एक्स एस x ∆T.
कदम
3 की विधि 1: Entanpy समस्या का समाधान

अभिकारक और उत्पाद का निर्धारण। सभी रासायनिक प्रतिक्रियाओं में अभिकारक और उत्पाद शामिल हैं। उत्पाद एक रासायनिक प्रतिक्रिया द्वारा बनाए गए रसायन होते हैं, जबकि अभिकारक ऐसे पदार्थ होते हैं जो उत्पादों को बनाने के लिए "परस्पर क्रिया, संयोजन, या विघटित" करते हैं। दूसरे शब्दों में, एक रासायनिक प्रतिक्रिया के अभिकारक को एक नुस्खा के घटक के रूप में माना जा सकता है, जबकि उत्पाद तैयार पकवान है। एक प्रतिक्रिया के findH को खोजने के लिए, हमें पहले अभिकारक और उसके उत्पाद को निर्धारित करना होगा।- उदाहरण के लिए, हाइड्रोजन गैस और ऑक्सीजन गैस से पानी बनाने वाली प्रतिक्रिया की थैलीपी को देखें। 2H2 (हाइड्रोजन गैस) + हे2 (ऑक्सीजन) → 2 एच2ओ (पानी)। इस प्रतिक्रिया में, एच2 तथा हे2 प्रतिक्रियावादी हैं, एच2हे उत्पाद है

प्रतिक्रिया में शामिल पदार्थों के कुल द्रव्यमान का निर्धारण करें। अगला कदम अभिकर्मक के द्रव्यमान को निर्धारित करना है। यदि आप इन मूल्यों को नहीं जानते हैं, या उन्हें माप नहीं सकते हैं, तो आप उनके घनत्व का उपयोग उनके वास्तविक द्रव्यमान को निर्धारित करने के लिए कर सकते हैं। घनत्व एक स्थिरांक है जिसे आवधिक तालिका (एक तत्व के लिए) या अन्य स्रोतों (अणुओं या यौगिकों के लिए) के खिलाफ पाया जा सकता है। रिएक्टर के मोल्स की संख्या से घनत्व को गुणा करके, आप इसमें शामिल रिएक्टर का द्रव्यमान पाएंगे।- ऊपर दिए गए उदाहरण में, अभिकारक क्रमशः 2 ग्राम और 32 ग्राम की घनत्व वाली हाइड्रोजन गैस और ऑक्सीजन गैस है। क्योंकि हम 2 मोल हाइड्रोजन (गुणांक "2" पूर्ववर्ती एच द्वारा निर्धारित) का उपयोग करते हैं2 प्रतिक्रिया में, और ऑक्सीजन का 1 मोल (कारक "1" पूर्ववर्ती एच द्वारा निर्धारित किया गया है2 प्रतिक्रिया में, हम प्रतिक्रिया में शामिल पदार्थों की कुल मात्रा की गणना करते हैं:
2 × (2g) + 1 × (32g) = 4g + 32g = 36g
- ऊपर दिए गए उदाहरण में, अभिकारक क्रमशः 2 ग्राम और 32 ग्राम की घनत्व वाली हाइड्रोजन गैस और ऑक्सीजन गैस है। क्योंकि हम 2 मोल हाइड्रोजन (गुणांक "2" पूर्ववर्ती एच द्वारा निर्धारित) का उपयोग करते हैं2 प्रतिक्रिया में, और ऑक्सीजन का 1 मोल (कारक "1" पूर्ववर्ती एच द्वारा निर्धारित किया गया है2 प्रतिक्रिया में, हम प्रतिक्रिया में शामिल पदार्थों की कुल मात्रा की गणना करते हैं:

उत्पाद की विशिष्ट गर्मी का निर्धारण करें। अगला, हमें उस प्रतिक्रिया के उत्पाद की विशिष्ट गर्मी क्षमता निर्धारित करने की आवश्यकता है जिसे हम देख रहे हैं। प्रत्येक तत्व या अणु का अपना कैलोरी मान होता है: यह निर्धारक होता है और अक्सर रासायनिक स्रोतों में बताया जाता है, जैसे कि एक पाठ्यपुस्तक के लिए। विशिष्ट ताप क्षमता को निर्धारित करने के कई तरीके हैं, हालांकि, हम जिस फॉर्मूला का उपयोग कर रहे हैं, उसके अनुसार इसे जूल / मलहम सी में व्यक्त किया जाता है।- ध्यान दें, यदि प्रतिक्रिया समीकरण में कई उत्पाद हैं, तो आपको उनमें से प्रत्येक को बनाने वाले घटक प्रतिक्रियाओं की थैलेपी की गणना करने की आवश्यकता है, फिर इन मूल्यों को एक साथ जोड़कर संपूर्ण प्रतिक्रिया की थैलेपी प्राप्त करने के लिए। ।
- हाइड्रोजन गैस और ऑक्सीजन गैस से पानी बनाने वाली प्रतिक्रिया के उदाहरण में, प्रतिक्रिया का अंतिम उत्पाद पानी है, पानी की विशिष्ट गर्मी के बारे में है 4.2 जून / जी डिग्री सेल्सियस.
प्रतिक्रिया का तापमान भिन्नता निर्धारित करें। इस चरण में, हम प्रतिक्रिया से पहले और बाद में तापमान में परिवर्तन अर्थात, गणना करेंगे। ∆T प्रतिक्रिया (T2) और प्रतिक्रिया के प्रारंभिक तापमान (T1) के बाद तापमान का अंतर है। अधिकांश रसायन विज्ञान समस्याओं के साथ, केल्विन (डिग्री के) डिग्री का उपयोग करना आवश्यक है, हालांकि डिग्री सी का भी उपयोग किया जा सकता है और वही परिणाम देगा।
- ऊपर जलीय प्रतिक्रिया के लिए, यदि प्रतिक्रिया का प्रारंभिक तापमान 185K है और जब प्रतिक्रिया समाप्त हो जाती है, तो तापमान 95K है। इस प्रकार, ∆T की गणना निम्नानुसार की जाती है:
∆T = T2 - T1 = 95K - 185K = -90K
- ऊपर जलीय प्रतिक्रिया के लिए, यदि प्रतिक्रिया का प्रारंभिक तापमान 185K है और जब प्रतिक्रिया समाप्त हो जाती है, तो तापमान 95K है। इस प्रकार, ∆T की गणना निम्नानुसार की जाती है:
सूत्र का उपयोग करें theH = म एक्स एस x ∆T। एक बार जब हमारे पास m का मान होता है, अर्थात अभिकारकों का द्रव्यमान, s मान, उत्पाद की विशिष्ट ऊष्मा, और ,T, प्रतिक्रिया के पहले और बाद के तापमान में अंतर, हम अभिक्रिया के आघात की गणना कर सकते हैं। उपरोक्त मानों को सूत्र में प्रतिस्थापित करके पत्र theH = म एक्स एस x .T, इकाई Jun (J) है।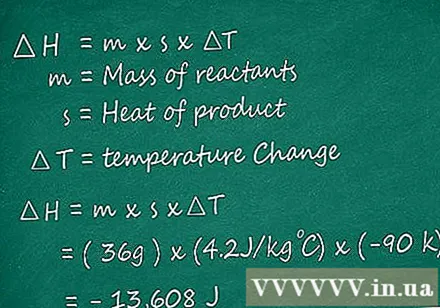
- उपरोक्त उदाहरण के साथ, हम इस प्रकार की प्रतिक्रिया की थैली की गणना करेंगे:
∆H = (36g) × (4.2 JK-1 g-1) × (-90K) = -13,608 जे
- उपरोक्त उदाहरण के साथ, हम इस प्रकार की प्रतिक्रिया की थैली की गणना करेंगे:
प्रतिक्रिया के थर्मल गुणों का निर्धारण करें। प्रतिक्रियाओं की theH की गणना करने के लिए सबसे आम कारणों में से एक यह देखना है कि क्या यह या तो एक एक्सोथर्मिक (गर्मी के रूप में ऊर्जा खोने) या एक एंडोथर्मिक (बढ़ती ऊर्जा और गर्मी अवशोषित) प्रतिक्रिया है। यदि थैलीपीई positiveH के परिणाम का संकेत सकारात्मक है, तो यह एंडोथर्मिक प्रतिक्रिया है। इसके विपरीत, यदि isH का चिन्ह ऋणात्मक है, तो यह एक एक्ज़ोथिर्मिक प्रतिक्रिया है। यह मूल्य जितना बड़ा होगा, प्रतिक्रिया का लाभ या ऊष्मा अधिक होगी। अत्यधिक बहिर्मुखी प्रतिक्रियाओं के साथ देखभाल की जानी चाहिए, क्योंकि इन प्रतिक्रियाओं से बड़ी मात्रा में ऊर्जा निकल सकती है और, यदि वे जल्दी से होते हैं, तो विस्फोट भी हो सकता है।
- हमारे उदाहरण में, अंतिम परिणाम -13608 जे है। चूंकि संकेत एक नकारात्मक संकेत है, यह प्रतिक्रिया एक प्रतिक्रिया है 'एक्ज़ोथिर्मिक। यह पूरी तरह से उचित है - एच2 में2 गैसीय रूप में, जबकि एच2ओ, प्रतिक्रिया का उत्पाद, फिर से तरल रूप में है। गर्म गैसों (जो वाष्प के रूप में मौजूद हैं) को एक तरल में बदलने के लिए वातावरण में ऊर्जा को एक निश्चित सीमा तक विकिरण करने की आवश्यकता होती है, अर्थात एच का गठन।2ओ ऊष्मा पैदा करेगा।
विधि 2 की 3: अनुमानित एंटपीपी
बाध्यकारी ऊर्जा का उपयोग थैलीसी का अनुमान लगाने के लिए किया जाता है। वस्तुतः सभी रासायनिक प्रतिक्रियाओं में परमाणुओं के बीच बंधन बनाना या तोड़ना शामिल है। क्योंकि एक रासायनिक प्रतिक्रिया में, ऊर्जा केवल उत्पादन या खो सकती है, अगर हम एक प्रतिक्रिया में बांड बनाने (या तोड़ने) के लिए आवश्यक ऊर्जा जानते हैं, तो उन सभी को एक साथ जोड़ दें। , हम पूरी तरह से प्रतिक्रिया की बहुत परिवर्तन का अनुमान लगा सकते हैं।
- उदाहरण के लिए, प्रतिक्रिया एच पर विचार करें2 + एफ2 → 2HF। इस मामले में, एच अणु के दो एच परमाणुओं के बीच बंधन को तोड़ने की ऊर्जा2 436 kJ / mol है, F बनाने के लिए आवश्यक ऊर्जा2 158 केजे / मोल है। तो, एच और एफ से एचएफ बनाने के लिए आवश्यक ऊर्जा है: -568 केजे / मोल। इस मान को 2 से गुणा करें, क्योंकि प्रतिक्रिया का उत्पाद है 2एचएफ, हमारे पास 2 × -568 = -1136 केजे / मोल है। इन सभी ऊर्जा मूल्यों को जोड़ने से यह पता चलता है:
436 + 158 + -1136 = -542 केजे / मोल.
- उदाहरण के लिए, प्रतिक्रिया एच पर विचार करें2 + एफ2 → 2HF। इस मामले में, एच अणु के दो एच परमाणुओं के बीच बंधन को तोड़ने की ऊर्जा2 436 kJ / mol है, F बनाने के लिए आवश्यक ऊर्जा2 158 केजे / मोल है। तो, एच और एफ से एचएफ बनाने के लिए आवश्यक ऊर्जा है: -568 केजे / मोल। इस मान को 2 से गुणा करें, क्योंकि प्रतिक्रिया का उत्पाद है 2एचएफ, हमारे पास 2 × -568 = -1136 केजे / मोल है। इन सभी ऊर्जा मूल्यों को जोड़ने से यह पता चलता है:
थैलीसी का अनुमान लगाने के लिए मानक थैलीसी का उपयोग करें। मानक एंटैपी किसी पदार्थ की प्रतिक्रिया में थैल्पी में परिवर्तन को चिह्नित करने वाला निर्धारित theH मान है। यदि आप एक रासायनिक प्रतिक्रिया में उत्पाद और अभिकारक को बनाने के लिए आवश्यक थैलेपी के मानक मूल्यों को जानते हैं, तो आप उन्हें ऊपर की ओर उल्लिखित बॉन्डिंग ऊर्जा के उपयोग के लिए थैलीपी का अनुमान लगाने के लिए जोड़ सकते हैं।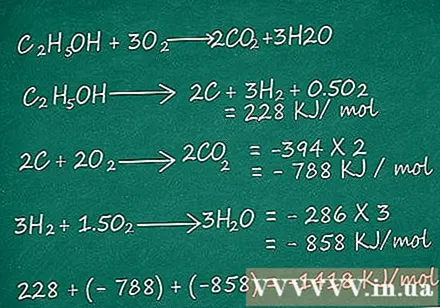
- उदाहरण के लिए, प्रतिक्रिया C पर विचार करें2एच5ओएच + 3 ओ2 → 2CO2 + 3 एच2ओ। इस मामले में, घटक प्रतिक्रियाओं के लिए मानक थैलेपी मान इस प्रकार हैं:
सी2एच5ओह → 2 सी + 3 एच2 + 0.5 ओ2 = 228 केजे / मोल
2 सी + 2 ओ2 → 2CO2 = -394 × 2 = -788 kJ / मोल
3H2 + 1.5 हे2 → 3 एच2ओ = -286 × 3 = -858 केजे / मोल
C की प्रतिक्रिया समीकरण प्राप्त करने के लिए हम इन घटक प्रतिक्रियाओं को एक साथ जोड़ सकते हैं2एच5ओएच + 3 ओ2 → 2CO2 + 3 एच2हे, यह वह प्रतिक्रिया है जिसे हम थैलेपी के लिए देख रहे हैं, इसलिए हम पूरी तरह से पूरी प्रतिक्रिया की थैलपी मूल्य प्राप्त करने के लिए ऊपर दिए गए घटक प्रतिक्रियाओं की थैलीपी जोड़ सकते हैं:
228 + -788 + -858 = -1418 केजे / मोल.
- उदाहरण के लिए, प्रतिक्रिया C पर विचार करें2एच5ओएच + 3 ओ2 → 2CO2 + 3 एच2ओ। इस मामले में, घटक प्रतिक्रियाओं के लिए मानक थैलेपी मान इस प्रकार हैं:
समीकरणों को बदलते समय संकेतों को बदलना सुनिश्चित करें। याद रखने के लिए एक महत्वपूर्ण बिंदु यह है कि जब पूरी प्रतिक्रिया की थैली की गणना करने के लिए अर्ध-प्रतिक्रियाओं के थैलेपी का उपयोग करते हैं, तो आपको प्रतिक्रिया के घटकों को स्वैप करते समय थैलेपी संकेत को बदलने की आवश्यकता होती है। दूसरे शब्दों में, यदि आप प्रतिक्रिया करने वाले या उत्पाद को नष्ट करने में सक्षम होने के लिए परिणामी प्रतिक्रिया की दिशा बदलते हैं, तो आपको उलट प्रतिक्रिया की थैली के संकेत को बदलने की आवश्यकता है।
- उपरोक्त उदाहरण में, हम देख सकते हैं कि प्रतिक्रिया सी का उत्पादन करती है2एच5ओएच का उपयोग विपरीत दिशा में किया जाता है। सी2एच5ओह → 2 सी + 3 एच2 + 0.5 ओ2 सी दिखाता है2एच5ओह टूट गया है, नहीं बना है। चूंकि हमने घटकों को ठीक से नष्ट करने में सक्षम होने के लिए प्रतिक्रिया की दिशा बदल दी है, इसलिए हमें प्रतिक्रिया की थैली के संकेत को बदलने की आवश्यकता है, इसलिए हमें 228 kJ / mol का मान मिलता है। वास्तव में, प्रतिक्रिया की तापीय धारिता C बनती है2एच5OH -228 kJ / mol है।
विधि 3 की 3: प्रयोग द्वारा Entanpy भिन्नता का निरीक्षण करें
एक साफ जार लें और इसे पानी से भरें। सरल प्रयोगों द्वारा हम आसानी से थैलेपी की भिन्नता का निरीक्षण कर सकते हैं। कुप्पी को कुल्ला और कीटाणुरहित करना आप सुनिश्चित करने के लिए उपयोग करना चाहते हैं कि कोई अशुद्धियाँ प्रतिक्रिया में न आए। वैज्ञानिक थैलेपी को मापने के लिए कैलीमीटर नामक एक सील कंटेनर का उपयोग करते हैं, लेकिन एक छोटे ग्लास का उपयोग करके आप उसी घटना को देख सकते हैं। जार को भरें जिसे आपने साफ कमरे के तापमान के पानी से साफ किया है। परीक्षण को ठंडे तापमान में घर के अंदर भी किया जाना चाहिए।
- इस प्रयोग के लिए, एक छोटा, तटस्थ माध्यम तैयार करें। हम पानी में अलका-सेल्टज़र (या किसी भी अपशिष्ट गोलियों) के थैलेपी-ट्रांसफ़ॉर्मिंग प्रभावों की जांच करेंगे। इसलिए, जितना कम पानी आप उपयोग करते हैं, उतनी ही अधिक संभावना है कि आप तापमान भिन्नता देखेंगे।
जार में एक थर्मामीटर रखें। एक थर्मामीटर लें और इसे जार में ठीक करें ताकि थर्मामीटर बल्ब बल्ब बोतल में पानी के स्तर से नीचे हो। पानी का तापमान पढ़ें; हम इस तापमान को प्रारंभिक तापमान T1 के रूप में लेते हैं।
- मान लीजिए कि हम पानी के तापमान को 10 डिग्री सेल्सियस के रूप में मापते हैं। निम्नलिखित चरणों में, हम इस मूल्य का उपयोग थाल्पी के सिद्धांत का वर्णन करने के लिए करेंगे।
अलका-सेल्टज़र टैबलेट लें और इसे जार में डालें। जब आप तैयार हों, तो जार में एक अलका-सेल्टज़र गोली गिराएं। गोली तुरंत बुदबुदाएगी। जब टैबलेट पानी में घुल जाता है, तो यह बाइकार्बोनेट (HCO) बनाने के लिए टूट जाता है3) और साइट्रिक एसिड (साइट्रिक एसिड हाइड्रोजन आयनों के रूप में प्रतिक्रिया करता है)। ये पदार्थ पानी और सीओ बनाने के लिए एक दूसरे के साथ प्रतिक्रिया करते हैं2 3HCO समीकरण के अनुसार3 + 3 एच → 3 एच2O + 3CO2.
प्रतिक्रिया समाप्त होने पर तापमान को मापें। प्रतिक्रिया देखें; गोली धीरे-धीरे पानी में घुल जाएगी। जैसे ही टैबलेट भंग हो जाता है, तापमान फिर से लें। आप देखेंगे कि पानी का तापमान अब शुरुआती T1 तापमान से कम होगा। यदि आप एक उच्च तापमान प्राप्त करते हैं, तो प्रतिक्रिया बाहरी कारकों से प्रभावित होती है (जैसे कि जिस कमरे में आपने प्रयोग किया है वह बहुत गर्म है)।
- मान लें कि जब टैबलेट भंग हो गया है तो तापमान 8 डिग्री सेल्सियस है।
प्रतिक्रिया की तापीय धारिता का अनुमान लगाएं। यदि आप अलका-सेल्टज़र टैबलेट को पानी, पानी और सीओ 2 में छोड़ देते हैं, तो आदर्श स्थिति पूरी हो जाती है2 (जो एक तैरता बुलबुला है) बनेगा और पानी के तापमान को कम करेगा। इस जानकारी से हम अनुमान लगा सकते हैं कि यह एंडोथर्मिक प्रतिक्रिया है; यही है, यह प्रतिक्रिया आसपास के वातावरण से तापमान उठाएगा। प्रतिक्रिया में भंग तरल अभिकर्मकों को गैसीय उत्पादों में बदलने के लिए ऊर्जा की आवश्यकता होती है, इसलिए वे ऊर्जा को पर्यावरण से गर्मी के रूप में लेते हैं (इस मामले में, पानी)। इसलिए, पानी का तापमान कम हो जाएगा।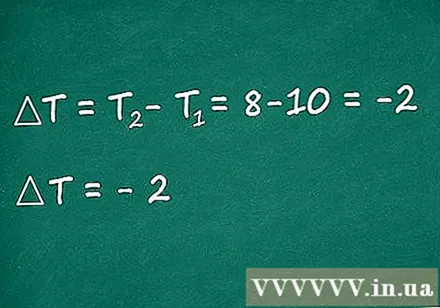
- इस उदाहरण के प्रयोग में, अलका-सेल्ज़र टैबलेट को पूरी तरह से भंग करने के बाद पानी का तापमान 2 डिग्री सेल्सियस गिर गया। यह हमारे फैसले के साथ पूरी तरह से सुसंगत है कि यह एक एक्ज़ोथिर्मिक प्रतिक्रिया है।
सलाह
- यहाँ की गणना तापमान इकाई केल्विन (K) - डिग्री सेल्सियस के समान एक तापमान पैमाने का उपयोग करती है। डिग्री सेल्सियस से डिग्री K में बदलने के लिए, आपको बस 273: K = जोड़ना या घटाना होगा। ° C + 273।
- आपको अलका-सेल्टज़र का उपयोग करने की आवश्यकता नहीं है, ऊपर प्रयोग में किसी भी प्रकार की प्यूपास्टिक गोलियों का उपयोग किया जा सकता है।