लेखक:
Lewis Jackson
निर्माण की तारीख:
8 मई 2021
डेट अपडेट करें:
25 जून 2024

विषय
शुद्ध आयनिक समीकरण रसायन विज्ञान का एक महत्वपूर्ण हिस्सा है क्योंकि यह केवल उन कणों का प्रतिनिधित्व करता है जो रासायनिक प्रतिक्रिया में बदलते हैं। वे सबसे अधिक ऑक्सीकरण-कमी प्रतिक्रियाओं, चयापचय प्रतिक्रियाओं और एसिड के बेअसरकरण प्रतिक्रियाओं में उपयोग किए जाते हैं - आधार। शुद्ध आयनिक समीकरण लिखने के लिए तीन बुनियादी चरण हैं: आणविक समीकरण को संतुलित करें, इसे पूर्ण आयनिक समीकरण (प्रत्येक पदार्थ समाधान में कैसे मौजूद है) में परिवर्तित करें, और अंत में शुद्ध आयनिक समीकरण लिखें।
कदम
2 का भाग 1: आयनिक समीकरण के घटकों को समझना
अणुओं और के बीच अंतर को जानें आयनिक यौगिक. शुद्ध आयनिक समीकरण लिखने में पहला कदम प्रतिक्रिया में आयनिक यौगिकों को निर्धारित करना है। आयनिक यौगिक वे हैं जो एक जलीय घोल में आयनों को अलग करते हैं और एक विद्युत आवेश होते हैं। आणविक यौगिक ऐसे यौगिक होते हैं जिनमें कभी विद्युत आवेश नहीं होता है। वे दो अधातुओं के बीच बनते हैं और कभी-कभी सहसंयोजक यौगिकों के रूप में संदर्भित होते हैं।
- आयनिक यौगिकों का निर्माण धातुओं और अधातुओं, धातुओं और पॉलीआटोमिक आयनों, या कई पॉलीएटोमिक आयनों के बीच किया जा सकता है।
- यदि आप अनिश्चित हैं कि यौगिक क्या है, तो आप आवर्त सारणी पर उस यौगिक के तत्वों को देख सकते हैं।

एक यौगिक की घुलनशीलता को पहचानो। सभी आयनिक यौगिक जलीय घोल में घुलनशील नहीं होते हैं, इसलिए वे आयनों में विघटित नहीं हो सकते हैं। बाकी समीकरण के साथ आगे बढ़ने से पहले आपको प्रत्येक यौगिक की घुलनशीलता की पहचान करनी चाहिए। नीचे विलेयता के नियमों का सारांश दिया गया है। इन नियमों के लिए अधिक विस्तृत जानकारी और अपवादों के लिए एक घुलनशीलता स्प्रेडशीट का पता लगाएं।- नीचे उल्लिखित क्रम में इन नियमों का पालन करें:
- सभी Na, K, और NH लवण4 सब पिघल गया।
- सभी सं लवण3, सी2एच3हे2, क्लो3और ClO4 सभी पिघल जाते हैं।
- सभी एजी, पीबी, और एचजी लवण2 सब पिघल गया।
- सभी Cl, Br और I लवण घुलनशील हैं।
- सभी सीओ लवण3, ओ, एस, ओएच, पीओ4, क्र4, सीआर2हे7, इसलिए3 भंग कर रहे हैं (कुछ मामलों को छोड़कर)।
- सभी एसओ लवण4 भंग कर रहे हैं (कुछ मामलों को छोड़कर)।
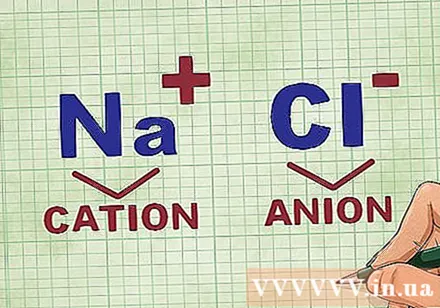
एक परिसर में पिंजरों और आयनों का निर्धारण। एक यौगिक में धनायन धनात्मक आयन होते हैं और आमतौर पर धातु होते हैं। आयनन यौगिक में ऋणात्मक आयन है और गैर-धात्विक है। कुछ अधातुएं धनायनों का निर्माण कर सकती हैं, लेकिन धातुएँ सदैव धनायन बनाती हैं।- उदाहरण के लिए, NaCl में, Na धनात्मक आवेशित धनायन है क्योंकि यह एक धातु है, और Cl ऋणात्मक रूप से आवेशित आयन है क्योंकि यह अधातु है।

प्रतिक्रिया में पॉलीऐटोमिक आयनों को पहचानें। पॉलीऐटोमिक आयनों में आवेशित अणु होते हैं जो कसकर एक साथ बंधे होते हैं और रासायनिक प्रतिक्रियाओं के दौरान अलग नहीं होते हैं। पॉलीऐटोमिक आयनों को पहचानना महत्वपूर्ण है क्योंकि उनके पास एक विशिष्ट आवेश होता है और वे विघटित नहीं होते हैं। पॉलीऐटोमिक आयनों का धनात्मक या ऋणात्मक आवेश हो सकता है।- यदि आप सामान्य रसायन विज्ञान का अध्ययन कर रहे हैं, तो अक्सर कुछ सामान्य बहुपद आयनों को याद रखना आवश्यक होता है।
- कुछ सामान्य पॉलीएटोमिक आयन सीओ हैं3, नहीं3, नहीं2, इसलिए4, इसलिए3, क्लो4 और क्लो3.
- आप रसायन विज्ञान की पुस्तकों में या इंटरनेट पर कई अन्य आयन भी पा सकते हैं।
भाग 2 का 2: शुद्ध आयनिक समीकरण लिखना
संतुलन आणविक समीकरण। शुद्ध आयनिक समीकरण लिखने से पहले, आपको यह सुनिश्चित करना चाहिए कि आपका आणविक समीकरण संतुलित है। समीकरण को संतुलित करने के लिए, आप यौगिक के सामने गुणांक जोड़ते हैं ताकि समीकरण के दोनों किनारों पर प्रत्येक तत्व की परमाणु संख्या बराबर हो।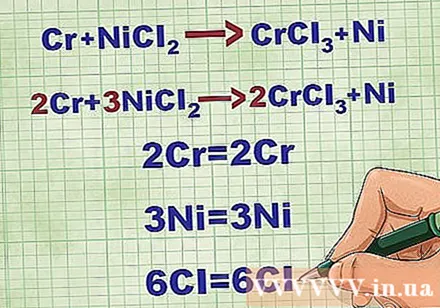
- समीकरण के दोनों तरफ प्रत्येक यौगिक को बनाने वाले परमाणुओं की संख्या लिखिए।
- प्रत्येक पक्ष को संतुलित करने के लिए ऑक्सीजन और हाइड्रोजन के अलावा अन्य तत्वों के सामने एक गुणांक जोड़ें।
- हाइड्रोजन परमाणु संतुलन।
- ऑक्सीजन परमाणु संतुलन।
- समीकरण के प्रत्येक पक्ष पर परमाणुओं की संख्या को सुनिश्चित करें कि वे संतुलित हैं।
- उदाहरण के लिए, Cr + NiCl2 -> CrCl3 + नी 2Cr + 3NiCl में संतुलित2 -> 2CrCl3 + 3Ni।
समीकरण में यौगिक की स्थिति को पहचानें। कई बार समस्या में आपको प्रत्येक कंपाउंड की स्थिति जानने के लिए कीवर्ड होते हैं। कई नियम हैं जो किसी तत्व या यौगिक की स्थिति को निर्धारित करने में मदद करते हैं।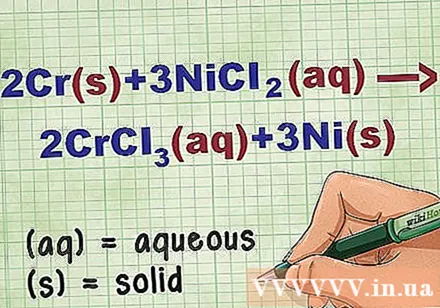
- यदि तत्व के लिए कोई राज्य प्रदान नहीं किया गया है, तो आवधिक तालिका पर पाए गए राज्य का उपयोग करें।
- यदि यौगिक को एक समाधान कहा जाता है, तो आप इसे जलीय या () के रूप में लिख सकते हैं।dd).
- यदि समीकरण में पानी है, तो आपको यह निर्धारित करना चाहिए कि आयनिक यौगिक पानी में घुलनशील स्प्रेडशीट का उपयोग करके घुलनशील है या नहीं। यदि घुलनशीलता अधिक है, तो यौगिक जलीय होगा (dd), यदि घुलनशीलता कम है, तो यौगिक ठोस होगा (आर).
- पानी के बिना, आयनिक यौगिक ठोस होता है (आर).
- यदि समस्या अम्लीय या बुनियादी है, तो यौगिक जलीय है (dd).
- उदाहरण के लिए, 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni। सीआर और नी के प्रारंभिक रूप ठोस अवस्था में हैं। एनआईसीएल2 और CrCl3 आयनिक यौगिक घुलनशील होते हैं, इसलिए वे जलीय होते हैं। समीकरण को फिर से लिखें: 2Cr(आर) + 3NiCl2(dd) -> 2CrCl3(dd) + 3Ni(आर).
निर्धारित करें कि कौन से यौगिक विलयन में विघटित (धनायन और आयनों में विघटित) होंगे। जब कोई पदार्थ या यौगिक विघटित होता है, तो यह धनात्मक रूप से आवेशित आयन (धनायन) और ऋणात्मक रूप से आवेशित आयन (आयन) में विघटित हो जाता है। ये घटक हैं जो शुद्ध आयनिक समीकरण के अंत में संतुलित होंगे।
- ठोस पदार्थ, तरल पदार्थ, गैसें, आणविक यौगिक, कम घुलनशीलता आयनिक यौगिक, पॉलीऐटोमिक आयन और कमजोर अम्ल नष्ट नहीं होंगे।
- आयनिक यौगिकों में उच्च घुलनशीलता (घुलनशीलता तालिका का उपयोग करें) और मजबूत एसिड 100% (एचसीएल) आयनीकृत करेंगे(dd), HBr(dd), नमस्ते(dd), एच2इसलिए4(dd), HClO4(dd), और HNO3(dd)).
- ध्यान दें, हालांकि पॉलीएटोमिक आयन किसी भी अधिक को अलग नहीं करते हैं, यदि वे उस यौगिक के घटक हैं, तो वे यौगिक से अलग हो जाते हैं।
परिसर से अलग प्रत्येक आयन के प्रभार की गणना करें। याद रखें कि धातुएं सकारात्मक आयन बनाएंगी और अधातु नकारात्मक आयन बनाएगी। किसी तत्व के चार्ज को निर्धारित करने के लिए आवर्त सारणी का उपयोग करें। आपको कंपाउंड में प्रत्येक आयन के आवेश को भी संतुलित करना होगा।
- इस उदाहरण में, NiCl2 CrCl में Ni और Cl में अलग किया गया3 Cr और Cl में विभाजित।
- Ni के पास 2+ का चार्ज है क्योंकि Cl के पास एक नकारात्मक चार्ज है लेकिन 2 परमाणु हैं। इसलिए, हमें 2 नकारात्मक Cl आयनों को संतुलित करना होगा। Cr में 3+ चार्ज है, इसलिए हमें 3 नकारात्मक Cl आयनों को संतुलित करना होगा।
- याद रखें कि पॉलीऐटोमिक आयनों का एक विशिष्ट चार्ज होता है।
पूर्ण आयनिक समीकरण लिखिए। कुछ भी जो विघटित या आयनित होता है (मजबूत एसिड) दो अलग-अलग आयनों में अलग हो जाता है। पदार्थ की स्थिति बनी हुई है (dd), लेकिन सुनिश्चित करें कि समीकरण संतुलित रहता है।
- ठोस, तरल पदार्थ, गैसें, कमजोर अम्ल, और कम घुलनशीलता आयनिक यौगिक, राज्य को बदलते या आयनों में अलग नहीं होते हैं। हम उन्हें बरकरार रखते हैं।
- आणविक पदार्थ विलयन में फैल जाएंगे, इसलिए उनकी स्थिति में परिवर्तन होगा ()dd)। तीन अपवाद नहीं हैं बनना (dd) है: सीएच4(क), सी3एच8(क), और सी8एच18(एल).
- उपरोक्त उदाहरण के साथ आगे बढ़ते हुए, पूर्ण आयनिक समीकरण इस तरह दिखता है: 2Cr(आर) + 3Ni(dd) + 6Cl(dd) -> 2Cr(dd) + 6Cl(dd) + 3Ni(आर)। जब Cl एक यौगिक में नहीं होता है, तो यह द्विध्रुवी नहीं होता है, इसलिए हम समीकरण के दोनों किनारों पर 6 Cl आयन प्राप्त करने के लिए यौगिक में परमाणुओं की संख्या से कारक को गुणा करते हैं।
समीकरण के प्रत्येक पक्ष पर समान आयनों को रद्द करके संतुलन आयनों को हटा दें। आप केवल तभी रद्द कर सकते हैं जब वे दोनों पक्षों (चार्ज, परमाणु संख्या, आदि) पर बिल्कुल समान हों। विनाशकारी पदार्थों के बिना समीकरण को फिर से लिखना।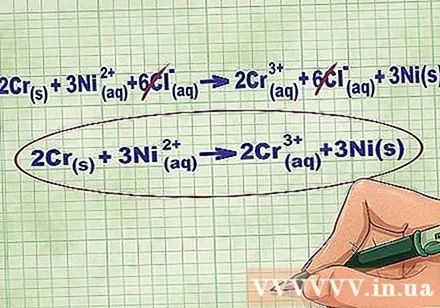
- उदाहरण पूरा करने के बाद, हमारे पास प्रत्येक तरफ 6 रद्द करने योग्य सीएल संतुलन है। शुद्ध आयनिक समीकरण 2Cr है(आर) + 3Ni(dd) -> 2Cr(dd) + 3Ni(आर).
- यदि आप सही हैं तो अभिकारक पक्ष पर कुल आवेश शुद्ध आयनिक समीकरण में उत्पाद पक्ष पर कुल आवेश के बराबर होना चाहिए।
सलाह
- समीकरण में सभी पदार्थों की स्थिति लिखें, यदि आप नहीं मर्जी अंक खोना।



